Fisiología de la Reproducción

Neuroendocrinología
La neuroendocrinología representa facetas de los dos campos tradicionales de la medicina: la endocrinología, que es el estudio de las hormonas (es decir sustancias secretadas al torrente sanguíneo que tienen diversas acciones en sitios remotos a partir del punto de secreción) y las neurociencias que constituyen el estudio de la acción de las neuronas.
Se conoce como neurosecreción el descubrimiento de neuronas que transmiten impulsos y segregan sus productos hacia el sistema vascular para que funcionen como hormonas, y demuestra que ambos sistemas están íntimamente relacionados. Por ejemplo la regulación del ciclo menstrual ocurre por retroalimentación de hormonas sobre el tejido nervioso del sistema nervioso central.
Hay dos lugares de acción fundamentales en el encéfalo que son importantes en el regulación de la función reproductora, el hipotálamo y la hipófisis. Antiguamente se consideraba que la hipófisis era la glándula principal. Luego surgió un nuevo concepto por el cual la hipófisis quedaba relegada a un papel subordinado como parte de una orquesta, con el hipotálamo como director, respondiendo a los mensajes del sistema nervioso central y periférico, y ejerciendo su influencia por medio de neurotransmisores transportados a la hipófisis por una red vascular portal. Con independencia del lugar dominante, la tesis convencional era que el complejo sistema nervioso central-hipófisis determinaba y dirigía la cronología de los acontecimientos evolutivos en un ovario reactivo. Sin embargo, los avances en los últimos veinte años indican que la secuencia compleja de acontecimientos conocida como ciclo menstrual está controlada por los esteroides sexuales y péptidos producidos en el propio folículo destinado a ovular. El hipotálamo y su dirección, y la hipófisis, son esenciales para el funcionamiento del mecanismo completo, pero la función endocrina que induce la ovulación se debe a la retroalimentación endocrina en la adenoipófisis.
Con este conocimiento, el médico puede comprender los efectos hasta ahora desconocidos pero importantes del estrés, el régimen de alimentación, el ejercicio y otras influencias en el eje hopofisario-gonadal.
Hipotálamo
El hipotálamo es una pequeña estructura nerviosa situada en la base del cerebro por arriba del quiasma óptico y por debajo del tercer ventrículo. Está conectado de manera directa con la hipófisis y es la parte del cerebro que se encarga de muchas secreciones hipofisarias. Desde el punto de vista anatómico, el hipotálamo se ha dividido en tres zonas: periventricular (adyacente al tercer ventrículo), medial (sobre todo cuerpos celulares) y lateral (primordialmente axoniano). Cada zona se subdivide a su vez en estructuras conocidas como núcleos, que representan los lugares de las concentraciones de tipos similares a los cuerpos celulares neuronales.
El hipotálamo no es una estructura aislada dentro del sistema nervioso central, sino que contiene Interconexiones múltiples con otras regiones del cerebro. Además de las vías bien identificadas de admisión de impulsos hipotalámicos hacia la hipófisis, hay otras numerosas de emisión de impulsos hacia diversas regiones del cerebro no tan bien caracterizadas, entre ellas el sistema límbico (amígdala e hipocampo), el tálamo y la protuberancia anular. Muchas de estás vías constituyen asas de retroalimentación hacia regiones que emiten estimulaciones nerviosas hacia el hipotálamo.
Hay diversos niveles de retroalimentación para el hipotálamo que se conocen como asas de retroalimentación larga. cortas y ultracortas. El asa de retroalimentación larga está compuesta por estimulación endocrina proveniente de las hormonas circulantes, y del mismo modo aquí se produce retroalimentación de andrógenos y estrógenos sobre los receptores de esteroides presentes en el hipotálamo. De manera semejante, las hormonas hipofisarias pueden retroalimentar al hipotálamo y sirven como funciones reguladoras importantes del asa de retroalimentación corta. Por ultimo las secreciones hipotalámicas pueden retroalimentar directamente al propio hipotálamo por medio de un asa de retroalimentación ultracorta.
Los productos secretores principales del hipotálamo son los factores liberadores de hormonas hipofisarias:
- Hormona liberadora de gonadotropina (GnRH), que controla la secreción de hormona luteinizante (LH) y hormona estimulante del folículo (FSH).
- Factor liberador de corticotropina (CRH), que controla la secreción de hormona adrenocorticotrópica (ACTH).
- Hormona liberadora de la hormona del crecimiento (GHRH), que regula la secreción de la hormona del crecimiento (GH).
- Hormona liberadora de tirotropina (TRH), que regula la secreción de la hormona estimulante del tiroides (TSH).
El hipotálamo es el origen de toda la producción de hormonas neurohipofisarias. La parte posterior de la hipófisis, considerada de tejido nervioso, se puede considerar como una extensión directa del hipotálamo conectada por el tallo infundibular digitiforme.
Hormonas de reproducción
Hipotálamo
Hormona liberadora de gonadotropina (GnRH).
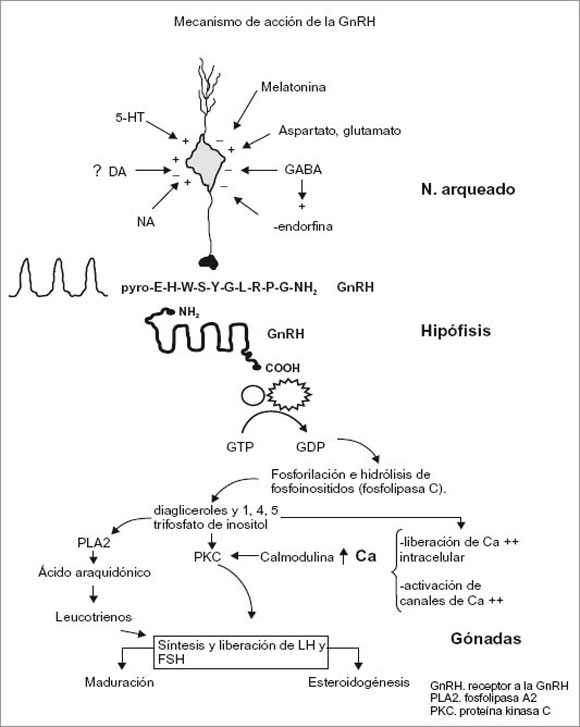
La GmRH (llamada también hormona liberadora de hormona luteinizante, o LHRH) es el factor encargado del control de la secreción de gonadotropina. Estas neuronas secretoras de GmRH proyectan axones que terminan en los vasos portales a nivel de la eminencia media, sitio en el que se secreta GmRH para su secreción hacia la hipófisis anterior. Es menos clara la función de múltiples proyecciones secundarias de las neuronas de GmRH hacia localizaciones dentro del sistema nervioso central.
Secreción pulsátil.
Entre las hormonas liberadoras, la GmRH tiene características únicas porque regula de manera simultánea la secreción de dos hormonas: FSH y LH (hormona estimulante del folículo y hormona luteinizante), Es también única entre las hormonas del cuerpo porque debe secretarse de manera pulsátil para ser eficaz, y su secreción pulsátil influye en la secreción de las dos gonadotropinas.
Se requiere de la secreción pulsátil sostenida de GmRH, porque esta hormona liberadora tiene una vida extremadamente breve (sólo de dos a cuatro minutos) como resultado de su segmentación proteolítica rápida. La secreción pulsátil de GmRH varía tanto en frecuencia como en amplitud durante todo el ciclo menstrual, y se encuentra regulada de manera muy precisa. La fase folicular se caracteriza por pulsos frecuentes de amplitud pequeña de secreción de esta hormona liberadora.
Durante la fase folicular tardía, se incrementan tanto la frecuencia como la amplitud de los pulsos. Sin embargo, durante la fase luteínica ocurre un alargamiento progresivo del intervalo entre los pulsos, al igual que una disminución en la amplitud de los mismos. Esta variación en la amplitud y la frecuencia de los impulsos es la encargada directa de la magnitud y las proporciones relativas de la secreción de gonadotropina desde la hipófisis, aunque el efecto de la GnRH será regulado por influencias hormonales adicionales sobre la hipófisis. Aunque la GnRH participa principalmente en la regulación endocrina de la secreción de gonadotropinas por la hipófisis, hoy se sabe que dicha molécula tiene funciones autocrinas y paracrinas en todo el cuerpo. Se encuentra el decapéptido en tejidos neuronales y no neuronales; hay receptores en muchas estructuras extrahipofisarias, incluidos ovario y placenta. Aún no se dilucida por completo el papel de la GnRH en tejidos extrahipofisarios.
Opiaceos endógenos y sus efectos sobre la hormona liberadora de gonadotropina (GnRH).
Los opiaceos endógenos son tres familias relacionadas de sustancias naturales producidas por el sistema nervioso central que representan los enlaces naturales para los receptores de opioides. Son tres las clases de opiaceos endógenos, cada una de ellas derivada de moléculas precursoras:
- Las endorfinas reciben este nombre por su actividad endógena del tipo de la que tiene la morfina. Estás sustancias se producen en el hipotálamo a partir de la sustancia precursora proopiomelanocortina (POMC) y tiene actividades diversas, entre ellas regulación de la temperatura, el apetito, el humor y la conducta.
- Las encefalinas funcionan sobre todo en la regulación del sistema nervioso autónomo. La proencefalina A es la precursora de las dos encefalinas de importancia primaria: metencefalina y leuencefalina.
- Las dinorfinas son opioides endógenos producidos por la precursora proencefalina B y tienen funciones semenjantes a las de las endorfinas.
Los opiodes endógenos desempeñan una función importante en la regulación de la funciónhipotalamohiporfisaria. Las endorfinas parecen inhibir la secreción de GmRH dentro del hipotálamo, lo que genera inhibición de la secreción de ganodotropinas. Los esteroides sexuales ováricos pueden incrementar la secreción de endorfinas centrales, con lo que disminuirán en mayor grado aún las concentraciones de gonadotropina.
Las concentraciones de endorfina varían en grado importante durante todo el ciclo menstrual, con niveles máximos durante la fase luteínica y un nadir durante la menstruación. Esta variedad inherente, aunque de utilidad para regular síntomas específicos del ciclo que experimentan las mujeres que ovulan. Por ejemplo, la disforia experimentada por algunas mujeres durante la etapa premenstrual del ciclo puede estar relacionada con la supresión de los opiáceos endógenos.
Hipófisis
La hipófisis se divide en tres regiones o lóbulos: anterior, intermedia y posterior. La hipófisis anterior (adenohipófisis) es muy diferente desde el punto de vista estructural de la posterior, que es neural (neurohipófisis), y que no es más que una extensión física directa del hipotálamo. La adenohipófisis se deriva desde el punto de vista embrionario del ectodermo epidérmico a partir de una invaginación del saco de Rathke. Por tanto, no está compuesta por tejido neural, como la hipófisis posterior, y no tiene conexiones neurales directas con el hipotálamo. Hay una relación anatómica única que combina los elementos de la producción nerviosa y la secreción endocrina. La propia adenohipófisis carece de riego sanguíneo arterial directo. Su fuente principal de sangre es también la fuente de estimulación hipotalámica: los vasos portales.
El flujo sanguíneo en estos vasos portales procede primordialmente desde el hipotálamo hacia la hipófisis. La sangre llega a la hipófisis posterior por las arterias hipofisarias superior, media e inferior. En contraste, la hipófisis anterior carece de riego sanguíneo arterial directo. Recibe sangre a través de un plexo capilar rico de los vasos portales que se originan en la eminencia media del hipotálamo y descienden a lo largo del tallo de la hipófisis. Sin embargo, esto no es absoluto, y se ha demostrado también flujo sanguíneo retrogrado. Este flujo sanguíneo, combinado con la localización de la eminencia media fuera de la barrera hematoencefálica, permite el control de retroalimentación bidireccinal entre ambas estructuras.
Las células secretoras específicas de la hipófisis anterior se han clasificado respecto de sus tipos de coloración con hematoxilina y eosina. Las células de coloración acidófila secretan primordialmente GH y prolactina y, en grado variable, hormona adrenocorticotrópica (ACTH). Las células basófilas secretan gonadotropinas y las células cromófobas de coloración neutral secretan hormona estimulante del tiroides (TSH).
Secreción de hormonas hipofisarias
- Hipófisis Anterior
La hipófisis anterior es la encargada de la secreción de factores liberadores de hormonas de primera importancia. FSH, LH, TSH y ACTH, lo mismo que GH y PROLACTINA. Hay un tipo específico de célula hipofisaria que secreta cada hormona.
Gonadotropinas
Las gonadotropinas FSH y LH se producen en las células gonadotropicas de la hipófisis anterior y son las encargadas de la estimulación folicular ovárica. Desde el punto de vista estructural hay gran semejanza entre la FSH y la LH.
Prolactina
La prolactina, polipéptido de 198 aminoácidos secretado por el lactótropo de la hipófisis anterior, es el factor trópico primario encargado de la síntesis de la leche por la mama. Desde el punto de vista clínico, las concentraciones aumentadas de prolactina se acompañan de amenorrea y galactorrea, y debe sospecharse hiperprolactinemia en cualquier mujer con síntomas de algunos de estos trastornos.
Hormona estimulante del tiroides (TSH), hormona adrenocorticotrópica (ACTH) y hormona del crecimiento (GH)
Las otras hormonas producidas por la hipófisis anterior son TSH, ACTH y GH. Los tirótropos hipofisarios secretan la TSH como reacción a la hormona liberadora de tirotropina (TSH). Al igual que la GnRH, la TRH se sintetiza primordialmente en el núcleo arqueado del hipotálamo y, a continuación, hacia la circulación portal para su transporte a la hipófisis. Además de estimular la secreción de TSH, la TRH es también un estimulo de primera importancia para la liberación de prolactina. La TSH estimula la secreción de T3 y T4 de la glándula tiroides, hormonas que a su vez retroalimentan de manera negativa a la secreción de TSH por la hipófisis. Las anomalías de la secreción tiroidea (tanto hipertiroidismo como hipotiroidismo) se acompañan a menudo de disfunción ovulatoria a causa de las diversas acciones sobre el eje hipotálamo-hipófisis-ovario.
- Hipófisis Posterior
Estructura y función:
La hipófisis posterior (neurohipofisis) está compuesta exclusivamente por tejido nervioso y es una extensión directa del hipotálamo.
Oxitocina: La oxitonita es un péptido de nueve aminoácidos producido ante todo para el núcleo paraventricular del hipotálamo. La función primaria de esta hormona en el ser humano es la estimulación de dos tipos específicos de contracciones musculares. El primer tipo, contracción muscular uterina, que se produce durante el parto. El segundo tipo es el constituido por las contracciones mioepiteliales del conducto lactífero de la mama durante el reflejo de “bajada” de la leche. La secreción de oxitocina puede ser estimulada por la succión, que desencadena una señal proveniente de la estimulación del pezón que se transmite por los nervios torácicos hacia la medula espinal y, desde ahí, hacia el hipotálamo, sitio en el que se libera la oxitrocina de manera pulsátil. La secreción de oxitocina puede ser desencadenada también por señales olfatorias, auditivas y visuales, lo mimo que como parte de un reflejo condicionado en los animales hembras que amamantan. Con la estimulación del cuello uterino y la vagina se produce una liberación importante de oxitrocina que puede desencadenar la ovulación releja (reflejo de Fergurson) en algunas especies, aunque no está clara la extensión a la que puede existir este efecto en la mujer.
Arginina-vasopresina: La AVP (conocida también como hormona antidiurética, o ADH) es el segundo producto secretor principal de la hipófisis posterior. La sintetizan primordialmente las neuronas cuyos cuerpos celulares se encuentran en los núcleos supraópticos. Su función principal es la regulación del volumen, la presión y la osmolalidad de la sangre circulante. Hay receptores específicos por todo el cuerpo que puede desencadenar la secreción de hormona antidiurética. La activación del sistema renal de renina-angiotensina puede activar también la secreción de arginina-vasopresina u hormona antidiurética.
Fisiología del Ciclo Menstrual
Durante el ciclo menstrual normal, hay producción cíclica ordenada de hormonas y proliferación paralela de la capa interna del útero (endometrio), como preparación para que se implante el embrión. Las alteraciones del ciclo menstrual y, de manera semejante, los de la fisiología menstrual pueden ocasionar diversos estados patológicos, entre ellos esterilidad, aborto de repetición y lesiones malignas.
Las alteraciones de la menstruación son uno de los motivos más frecuentes por los que las mujeres solicitan asistencia médica. Aunque de utilidad para formular un diagnóstico o un plan terapéutico, las anomalías específicas del flujo menstrual no están relacionadas directamente con causas únicas.
- Definiciones de las irregularidades del ciclo menstrual
- Oligomenorrea: Hemorragias poco frecuentes y de aparición irregular que suelen ocurrir a intervalos de más de 35 días.
- Polimenorrea: Hemorragias frecuentes pero de aparición regular que suelen ocurrir a intervalos de 21 días o menos.
- Menorragia: Hemorragias de aparición regular que son excesivas (<80 ml) y de duración prolongada del flujo (> 5 días)
- Metrorragia: Hemorragia de aparición irregular.
- Menometrorragia: Hemorragia prolongada excesiva que se produce a intervalos frecuentes pero irregulares.
- Hipomenorrea: Hemorragia que ocurre con regularidad y en cantidad disminuida.
- Hemorragia intermenstrual: Hemorragia (por lo general no en cantidad excesiva) que se produce entre ciclos menstruales por lo demás normales.
Ciclo menstrual normal
El ciclo menstrual humano normal, para su estudio, se puede dividir en dos partes: el ciclo ovárico y el ciclo uterino, con base en el órgano que se examina en cada uno (ambos cambios suceden a la vez). El ciclo ovárico puede dividirse además en fases folicular y luteínica, en tanto que el ciclo uterino se divide en las fases proliferativa y secretora correspondientes. Las fases del ciclo ovárico se caracterizan como sigue:
- Fase folicular
La retroalimentación hormonal promueve, el desarrollo ordenado de un solo folículo dominante, que debe madurar a la mitad del ciclo y prepararse para la ovulación. La duración promedio de la fase folicular humana varía entre 10 y 14 días, y la variabilidad de esta duración es la causa de la mayor parte de las variaciones en la duración total del ciclo. - Fase luteínica
Abarca el tiempo transcurrido entre la ovulación y el principio de la menstruación, con una duración promedio de 14 días.
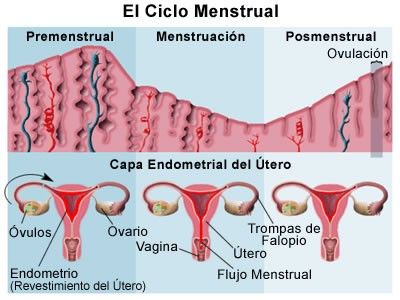
El ciclo menstrual normal varía entre 21 y 35 días, con dos a seis días de flujo sanguíneo y un promedio de pérdida de sangre de 20 a 60 ml. Sin embargo, los estudios en gran cantidad de mujeres con ciclos normales han demostrado que sólo cerca de dos terceras partes de las mujeres adultas, tienen ciclos que duran de 21 a 35 días. Los extremos de la vida reproductiva (después de la menarquía y durante el periodo perimenopáusico) se caracterizan por un porcentaje más alto de ciclos anovulatorios o que ocurren con irregularidad.
Útero
Cambios cíclicos del endometrio
Hay cambios histológicos cíclicos del endometrio de la mujer adulta. Estos cambios prosiguen de manera ordenada como reacción a la producción hormonal cíclica de los ovarios. El ciclo histológico del endometrio se puede considerar mejor en dos partes: las glándulas endometriales y el estroma circundante. Los dos tercios superficiales del endometrio constituyen la zona que prolifera y que acaba por desprenderse con cada ciclo si no sobreviene el embarazado. Esta porción cíclica del endometrio se conoce como decidua funcional, y está compuesta por una zona intermedia profunda (capa esponjosa) y una zona compacta superficial (capa compacta). La decidua basal es la región más profunda del endometrio y no experimenta proliferación mensual importante: mejor dicho, es la encargada de la regeneración endometrial después de cada menstruación.
- Fase proliferativa
POR CONSENSO GENERAL, EL PRIMER DÍA DE LA HEMORRAGIA VAGINAL, SE DENOMINA PRIMER DÍA DEL CICLO MENSTRUAL. Después de la menstruación, la decidua basal está compuesta por glándulas primordiales y estroma denso escaso en su localización adyacente al miometrio. La fase proliferativa se caracteriza por crecimiento mitótico progresivo de la decidua funcional como preparación para que se implante el embrión en respuesta a las concentraciones circulantes crecientes de estrógenos. Después de iniciarse la fase proliferativa, el endometrio es relativamente delgado (1 a 2 mm). El cambio predominante que se observa durante esta época es la evolución de las glándulas endometriales al principio rectas, estrechas y cortas para convertirse en elementos más largos y tortuosos.
- Fase secretora
Durante el ciclo típico de 28 días, la ovulación se produce el día 14. En el plazo de 28 a 72 horas después de acontecer la ovulación, el inicio de la secreción de progesterona produce un cambio en el.phpecto histológico del endometrio hacia la fase secretora, denominada así por la presencia clara de productos secretores eosinófilos ricos en proteínas en la luz glandular. En contraste con la fase proliferativa, la fase secretora del ciclo menstrual se caracteriza por los efectos celulares de la progesterona además de los producidos por los estrógenos. En general, los efectos de la progesterona son opuestos a los efectos de los estrógenos, y hay una disminución progresiva en la concentración de los receptores de estrógenicos en las células endometriales. Como resultado, durante la segunda mitad del ciclo sobreviene antagonismo de la síntesis de DNA inducida por los estrógenos y de la mitosis celular.
Menstruación
En ausencia de implantación, se interrumpe la secreción glandular y ocurre una desintegración irregular de la decidua funcional. El resultado del desprendimiento de esta capa del endometrio, es el proceso denominado menstruación. La destrucción del cuerpo amarillo (lúteo) y de su producción de estrógenos y progesterona es la causa más directa del desprendimiento. Al desaparecer los esteroides sexuales, hay un espasmo profundo de las arterias espirales que, por último, produce isquemia endometrial. De manera simultánea, se produce desintegración de los lisosomas y liberación de enzimas proteolíticas, que promueven en mayor grado aún la destrucción del tejido local. A continuación se desprende esta capa del endometrio, y deja a la decidua basal como el origen del crecimiento endometrial subsecuente. Durante todo el ciclo menstrual se producen prostaglandinas, y su concentración más alta ocurre durante la menstruación. La prostaglandina F2? (PGF2? ) es una sustancia vasoconstrictora potente que produce vasospasmo arteriolar ulterior e isquemia endometrial. La PCF2? produce también contracciones miometriales que disminuyen el flujo sanguíneo local de la pared uterina, y que pueden servir además para la expulsión física del tejido endometrial desprendido desde el útero.
Ovario
Desarrollo del folículo del ovario
Hacia la vigésima semana de la gestación, el número de oocitos es máximo, a un nivel de seis a siete millones. Simultáneamente y con un nivel máximo en el quinto mes de gestación) ocurre atresia de los oocitos seguida con rapidez por artesia folicular. Al nacer, solo quedan en el ovario un a dos millones de oocitos, y durante la pubertad sólo se dispone para la ovulación de 300.000 de los seis a siete millones originales de oocitos. De éstos, sólo ovularán por último 400 a 500, y en el momento de la menopausia, el ovario estará compuesto primordialmente por tejido de estroma denso con sólo raros oocitos residuales intercalados.
En la mujer no hay formación de oogonios o mitosis después del nacimiento. Como los oocitos entran en la etapa de diploteno de descanso de la meiosis en el feto y persisten en esta etapa hasta la ovulación, se habrán sintetizado durante ésta Fran parte del ácido desoxirribonucleico (DNA), las proteínas y el ácido ribonucleico mensajero (mRNA) necesarios para el desarrollo del embrión antes de la implantación, En la etapa de diploteno, el oogonio está rodeado por una sola capa de 8 a 10 células de la granulosa para formar el folículo primordial. Los oogonios que no quedan rodeados de la manera apropiada por células de la granulosa experimentan atresia.
Paro meiótico de los oocitos y readopción de la actividad.
La meiosis (proceso de la célula germinal para reducción de la división) se clasifica a menudo en cuatro fases: profase, metafase, anafase y telofase. La profase de la meiosis I se subdivide aún en cinco etapas: leptoteno, cigoteno, paquiteno, diploteno y diacinesis.
Los oogonios difieren de los espermatogonios en que sólo se forman una célula hija final (oocito) a partir de cada célula precursora, con eliminación del material genético en exceso en tres cuerpos polares. Cuando los oogonios en desarrollo empiezan a entrar en la profase I meiótica, se conocen como oocitos primarios. Este proceso se inicia burdamente durante la octava semana de gestación. Sólo los oogonios que entran en la meiosis sobrevivirán a la onda de atresia que barre el ovario fetal antes del nacimiento. Los oocitos detenidos en la profase (en la etapa tardía de diploteno o “dictiato”) se conservarán así hasta el momento de la ovulación, en que se reasumirá el proceso de la meiosis. Se cree que el mecanismo de dicha estasis mitotica es un inhibidor de la maduración del oocito (OMI) producido por las células de la granulosa. Este inhibidor logra acceso al oocito a través de las uniones de intervalo que lo conectan con el montículo de células de la granulosa que lo rodean. Mediante la secreción rápida de LH durante la mitad del ciclo, las uniones de intervalo se transtornan, las células de la granulosa ya no están más conectadas con el oocito y se permite que se readopte la meiosis I.
Desarrollo folicular
El desarrollo folicular es un proceso dinámico que prosigue desde la menarquia hasta la menopausia. Tiene como finalidad permitir el reclutamiento mensual de una cohorte de folículos y, por ultimo, la liberación de un solo folículo maduro dominante durante la ovulación cada mes.
- Folículos primordiales. El reclutamiento y el crecimiento iniciales de los folículos primordiales son independientes de las gonadotropinas y afectan a un grupo durante varios meses. Sin embargo, no se conocen aún los estímulos responsables encargados de la agrupación del conjunto específico de folículos en cada ciclo. Durante la etapa folicular primordial, poco después del reclutamiento inicial, la FSH adopta el control de la diferenciación y el crecimiento foliculares y permite que siga diferenciándose una cohorte de folículos. Esto señala el cambio del crecimiento independiente de gonadotropina hacia el dependiente de ésta. Los primeros cambios que se observan son crecimiento del oocito y ampliación de la capa única de células foliculares granulosas en una capa múltiple de células cuboideas. La disminución de la progesterona durante la fase luteínica y la producción en estos momentos a partir del ciclo previo permiten el incremento de la FSH que estimula el crecimiento folicular.
- Folículo preantral. Durante los varios días que siguen a la desintegración del cuerpo lúteo (amarillo) prosigue el crecimiento de la cohorte de folículos bajo el influjo de la hormona estimulante del folículo. El oocito que está aumentando de tamaño secreta, a continuación, una sustancia rica en flucoproteinas, la zona pelucida, que lo separa de las células de la granulosa circundantes (excepto para la unión de intervalo mencionada). Con la transformación desde folículo primordial hasta preantral, prosigue la proliferación mitótica de las células de la granulosa que lo rodean, Al mismo tiempo proliferan las células de teca en el estroma limítrofe de las células de la granulosa. Ambos tipos de células funcionan de manera sinergista para producir estrógenos que se secretan hacia la circulación general. Durante esta etapa del desarrollo, cada uno de los miembros al parecer idénticos debe seleccionarse para el dominio o experimentar atresia. Es probable que el folículo destinado a la ovulación se haya seleccionado antes de este momento, aunque no ha podido dilucidarse aún el mecanismo de dicha selección.
- Folículo preovulatorio. Los folículos preovulatorios se caracterizan por un antro lleno de líquido que está compuesto por plasma con secreciones de las células de la granulosa. En este momento las células de la granulosa, se han diferenciado en mayor grado aún hasta convertirse en una población heterogénea. El oocito se conserva en contacto con el folículo mediante un pedículo de células de la granulosa especializadas conocido como montículo germinal (cumulus oophourus).
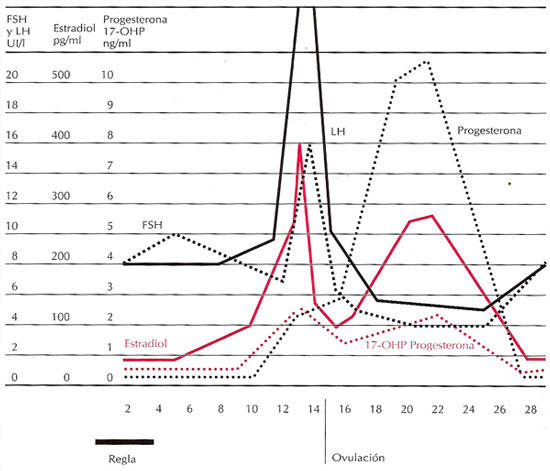
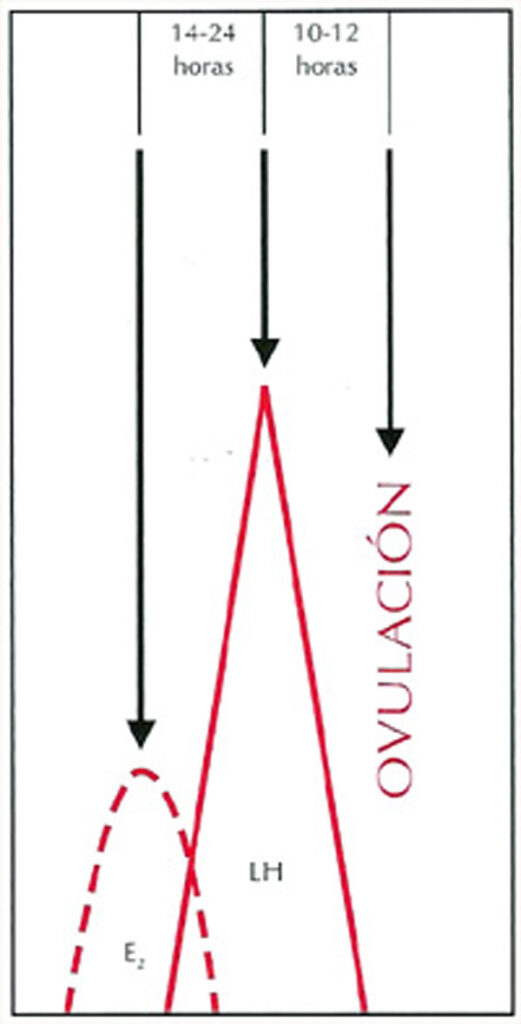
La elevación de los niveles de concentración de estrógenos, produce una reacción negativa en la secreción de FSH. A la inversa, la LH experimenta regulación bifásica por acción de los estrógenos circulantes. A concentraciones más bajas, los estrógenos son inhibidores para la secreción de LH. A concentraciones más altas, incrementan la secreción de esta hormona. Esta estimulación requiere una concentración sostenida de estrógenos (> 200 pg/ml) durante más de 48 horas. A su vez las elevadas concentraciones de estrógenos producen un efecto positivo de reacción (feed back) y una secreción importante en forma de ola de LH. Al mismo tiempo que sucede esto la interacción estrógeno FSH a nivel local del folículo dominante estimula los receptores LH en las células de la granulosa (capa interna del folículo ovárico). De esta manera la exposición de concentraciones alta de LH ocasiona una reacción específica del folículo dominante: el resultado final es la luteinización (formación del cuerpo amarillo) de las células de la granulosa, la producción de progesterona y el desencadenamiento de la ovulación.
En general, la ovulación acontece en un folículo único maduro (folículo de De Graaf) entre 10 y 12 horas después del pico (elevación máxima) de LH ó entre 34 y 36 horas desde el inicio del incremento a mitad del ciclo de LH.
Los esteroides sexuales no son los únicos reguladores del desarrollo folicular a través de las gonadotropinas,. Se han identificado dos peptidos derivados de células de la granulosa que tienen funciones opuestas en la retroalimentación hipofisiaria . El primero de ellos, o inhibina, se secreta en dos formas: A y B. La inhibina B se secreta sobre todo en la fase folicular y es estimulada por FSH en tanto la inhibina A tiene acción principal en la fase luteínica. Ambas formas actúan inhibiendo la síntesis y secreción de FSH. El segundo péptido, activita, estimula la secreción de FSH desde la hipófisis y potencia su acción sobre el ovario. Es probable que haya otros numerosos reguladores intraovaricos semejantes a la inhibina y a la activita, cada uno de los cuales puede desempeñar una función básica en la promoción del proceso ovulatorio normal. Algunos de ellos son factor del crecimiento del tipo insulina 8ILGF), factor del crecimiento epidérmico (EGF), factor de transformación del crecimiento (TGF)? TGF-ß1, factor del crecimiento fibroblastos ß (ß-FGF) IL-1, TNF-?, inhibidor de la maduración del oocito (OMI) y renina-angiotensina.
Ovulación
La fase rápida de secreción de LH a la mitad del ciclo es la causa del incremento impresionante de las concentraciones locales de prostaglandinas y enzimas proteolíticas en la pared folicular. Estas sustancias debilitan de manera progresiva la pared folicular y permiten, por ultimo, que se forme una perforación. La ovulación representa con mayor probabilidad una expulsión lenta del oocito a través de esta abertura en el folículo, más que el entallamiento de la estructura folicular. De hecho, se han registrado mediciones directas de las presiones intrafoliculares y no se ha podido demostrar este suceso explosivo.
Fase luteínica
Estructura del cuerpo amarillo. Después de la ovulación, la corteza folicular restante se transforma en el regulador primario de la fase luteínica: el cuerpo lúteo (amarillo). Las células de la granulosa y membranosas que quedan en el folículo empiezan a captar líquidos y desarrollan el pigmento amarillo característico de la luteína a causa del cual ha recibido su nombre. Estas células son estructuras secretoras activas que producen progesterona, que brinda apoyo al endometrio de la fase luteínica. Por añadidura, se producen estrógenos e inhibina A en cantidades importantes. A diferencia del proceso que ocurre en el folículo en desarrollo, la membrana basal del cuerpo amarillo degenera para permitir que los vasos sanguíneos en proliferación invadan las células luteinitas de la granulosa en respuesta a la secreción de factores angiogenos, como el factor del crecimiento endotelial vascular. Esta respuesta angiógena permite que entren grandes cantidades de hormonas luteínicas en la circulación general.
- Función y regulación hormonales
Los cambios hormonales de la fase luteínica se caracterizan por una serie de interacciones de retroalimentación negativa diseñadas para producir regresión del cuerpo amarillo si no sobreviene el embarazo. Los esteroides del cuerpo amarillo (estradiol y progesterona) producen retroalimentación central negativa lo mismo que disminución de las secreciones del FSH y LH. La secreción sostenida de ambosesterioides disminuirá los estímulos para el reclutamiento folicular subsecuente. De manera semejante, la secreción luteínica de inhibina potencia también la supresión de hormona estimulante del folículo. En el ovario, la producción local de progesterona inhibe el desarrollo y el reclutamiento ulteriores de folículos adicionales.
La función sostenida del cuerpo lúteo (amarillo) depende de la producción sostenida de LH. En ausencia de esta estimulación, el cuerpo lúteo regresará de manera invariable después de 12 a 16 días y formará el cuerpo flanco de tipo cicatrizal. Sin embargo, no está claro el mecanismo preciso de luteólisis, y es muy probable que abarque también factores paracrinos locales. En ausencia de embarazo, el cuerpo lúteo experimenta regresión y se desvanecen las concentraciones de estrógenos y progesterona. Esto, a su vez, elimina la inhibición central de la secreción de gonadotropina y permite que se incrementen de nuevo las concentraciones de FSH y LH, y recluten otra cohorte de folículos.
Si sobreviene el embarazo, la gonadotropina coriónica humana placentaria (hCG) imitará la acción de la LH y estimulará de manera sostenida el cuerpo lúteo para que secrete progesterona. Por tanto la implantación con buenos resultados tiene como consecuencia apoyo hormonal para permitir la conservación sostenida del cuerpo lúteo y del endometrio. Las pruebas obtenidas
Glándula pineal
Aunque no se ha establecido con claridad una función fisiológica en el ser humano, las funciones reproductivas del hipotálamo pueden estar también bajo el control inhibitorio del encéfalo a través de la glándula pineal, Esta glándula surge como una excrescencia del techo del tercer ventrículo, pero poco después del nacimiento pierde todas las conexiones nerviosas aferentes con el encéfalo. En su lugar, las células parenquimatosas reciben una inervación simpática nueva y atípica que permite a la glándula pineal ser un órgano neuroendocrino activo que responde a estímulos foticos y hormonales y muestra ritmos circadianos.
La vía nerviosa se inicia en la retina, pasa por los núcleos supraquiasmático y paraventricular en el hipotálamo y llega a los fascículos ópticos, accesorios inferiores y al haz presencefálico medial hasta la porción superior de la médula espinal. Las fibras preganglionares terminan en el ganglio cervical superior, mientras que los nervios simpáticos terminan directamente en las células pineales. La interrupción de esta vía produce el mismo efecto que la oscuridad, es decir, un incremento de la acción biosintética pineal.
La hidroxiindol-o-metiltransferasa (HIOMT), una enzima esencial para la síntesis de la melatonina, está presente fundamentalmente en las células parenquimatosas pineales, y sus productos son básicamente específicos de la glándula pineal. La noradrenalina estimula la entrada de triptófano en la célula pineal y también la actividad de la adenilato ciclasa en la membrana. El incremento resultante del AMP cíclico propicia la actividad de la N-acetiltransferasa, el paso limitador de la velocidad en la síntesis de melatonina. El triptófano se convierte en melatonina por la acción combinada de la N.acetiltransferasa y la HIOMT. Así pues, la síntesis de melatonina está controlada por la estimulación de la adenilao ciclasa por noradrenalina, y ésta se libera por estimulación simpática como consecuencia de la falta de luz. La HIOMT también está presente en la retina, donde la melatonina puede actuar regulando el pigmento en las células retinianas y en el intestino. Sin embargo, la pinealectomía suprime por completo las concentraciones detectables de melatonina en la circulación. Por otra parte, es frecuente la calcificación de la glándula pineal, sobre todo en niños pequeños. Además, casi todos los ancianos presentas calcificación de la pineal.
La asociación de tumores peniales hiperplásticos con disminución de la función gonadal y de tumores destructivos con pubertad precoz, llevó a pensar que la glándula pineal es el origen de sustancias que inhiben las gónadas. Sin embargo, puede que los mecanismos pineales no sean absolutamente esenciales para la función gonadal. La función reproductora normal se recupera en la rata pinealectomizada varias semanas después de la pinealectomía: las mujeres ciegas tienen una fertilidad normal, y la pinealectomía en un primate no afectó al desarrollo puberal.
OSCURIDAD –> AUMENTO DE LA MELATONINA –> DISMINUCIÓN DE LA GnrRH
Una rata que recibe una luz constante desarrolla una glándula pineal pequeña con disminución de la HIOMT y la melatonina, mientras que aumenta el peso del ovario. Una rata sometida a una oscuridad constante presenta los efectos contrarios, es decir, aumento del tamaño de la glándula pineal, de la HIOMT y de la melatonina, y disminución del peso del ovario y de la función hipofisaria. La presencia o ausencia de luz establece un ritmo en la actividad de la HIOMT pineal. Los días cortos y las noches largas provocan atrofia de las gónadas, y este es el mecanismo fundamental que gobierna el celo. En los seres humanos, la secreción de melatonina aumenta después de los picos de oscuridad en mitad de la noche, y luego disminuye. Este ritmo es endógeno y se origina en el núcleo supraquiasmático. La luz no origina el ritmo, pero influye en su cronología.
Una posible función en los seres humanos puede ser proporcionar ritmo circadiano a otras funciones como la temperatura y el sueño. En todos los vertebrados analizados hasta la fecha, la secreción de melatonina tiene un ritmo diario y estacional: valores elevados con la oscuridad y bajos con la luz, mayor secreción en el invierno que en el verano. La desincronización con viajes a través de husos horarios podría contribuir al complejo sintomático conocido como síndrome de desfase horario. La ingestión de melatonina mejora la duración y la calidad del sueño, pero se desconoce el momento de administración óptimo.
Por tanto, la glándula pineal sirve de conexión entre el ambiente y la función hipotalámica-hipofisiaria. Con el fin de interpretar correctamente la duración del día, los animales necesitan un ritmo diario en la secreción de melatonina, Esta coordinación de la información ambiental temporal es especialmente importante en los animales que se reproducen de manera estacional. Para este ritmo pineal, parece ser necesario el núcleo suproquiasmático, quizá el lugar en que se coordinan la función pineal y los cambios de luz.
La melatonina es sintetizada y secretada por la glándula pineal y circula en la sangre como una hormona clásica. Afecta a órganos a distancia, en especial los centros neuroendocrinos del sistema nervioso central. Se sigue debatiendo si la melatonina se secreta fundamentalmente en el LCR o la sangre, pero la mayor parte de los datos favorecen a esta última. La melatonina puede llegar al hipotálamo desde el LCR a través del transporte por los tanicitos.
Los cambios gonadales relacionados con la melatonina están mediados a través del hipotálamo y denotan un efecto supresor general sobre la secreción pulsátil de GnRH y la función reproductora. En los seres humanos las concentraciones sanguíneas de melatonina son máximas en el primer año de vida (más altas por la noche) y luego disminuyen con la edad y, según algunos, acaban induciendo la supresión de GnRH antes de la pubertad. La asociación de la ceguera en mujeres con una menarquia más temprana de lo normal pone en tela de juicio está hipótesis. Además, las pinealectomía en monos no afecta a la pubertad. Otros autores no han observado una disminución de las concentraciones de melatonina con el paso del tiempo.
La actividad de la glándula pineal se puede considerar como un equilibrio neto entre las influencias mediadas por hormonas y neuronas. Esta glándula contiene receptores para las hormonas sexuales activas, estradiol, testosterona, dihidrotestosterona, progesterona y prolactina. Además, la glándula pineal convierte la testosterona y la progesterona en metabolitos 5?-reducidos activos, y los andrógenos se aromatizan a estrógenos. También parece ser excepcional en el sentido de que un neurotransmisor catecolamínico (noradrenalina), al interaccionar con los receptores de la membrana celular, estimula la síntesis celular de receptores estrogénicos y androgénicos. Sin embargo, en general, la actividad simpática que origina el ritmo circadiano tiene prioridad sobre los efectos hormonales.
A pesar de diversos indicios sugestivos, no se ha demostrado definitivamente ninguna función definitiva de la glándula pineal en los seres humanos. No obstante, la importante relación entre la exposición a la luz y los ritmos circadianos continúa concentrando la atención sobre la glándula pineal como estructura coordinadora. Existe una distribución estacional de la concepción humana en los países septentrionales, con una disminución de la actividad ovárica y de las tasas de concepción durante los oscuros meses de invierno. Además, la glándula pineal puede interrumpir la función gonadal normal. Se ha descrito un varón con pubertad tardía por hipogonadotropismo, el cual presentaba una glándula pineal hipertrofiada e hiperfuncional. Con el tiempo, sus concentraciones de melatonina disminuyeron espontáneamente y se desarrolló una función hipofisiaria y gonadal normal. Se han comunicado concentraciones nocturnas elevadas de melatonina en pacientes con amenorrea hipotalámica y en mujeres con anorexia nerviosa, pero es probable que este incremento sea una consecuencia de las bajas concentraciones de estrógenos y no etiológico.
Una posible influencia de la glándula pineal puede ser la sincronización de los ciclos menstruales observada en mujeres que pasan tiempo juntas. El aumento significativo de la sincronización de los ciclos se describió por primera vez en 1971 entre compañeras de habitación y entre amigas íntimas en los cuatro primeros meses de residencia en un colegio mayor para mujeres.
Se ha observado un aumento similar de la sincronía en mujeres compañeras de trabajo que colaboraban en ocupaciones caracterizadas por niveles de interdependencia iguales o superiores a los niveles de estrés laboral identificados en familias de beduinos en las que las mujeres viven juntas durante muchos años. Sin embargo, no siempre han tenido éxito los esfuerzos para reproducir estos resultados. Algunos datos indican que la cronología de la ovulación puede resultar afectada por feromonas humanas axilares.

Secreción de gonadotropinas durante la vida fetal, la infancia y la pubertad.
Con frecuencia hemos considerado los acontecimientos endocrinos durante la pubertad como un despertar, un comienzo. Sin embargo, desde el punto de vista endocrinológico, la pubertad no es un comienzo sino sólo otra fase en un desarrollo iniciado en la concepción. El desarrollo de la adenohipófisis en el ser humano empieza entre las semanas cuarta y quinta de la vida fetal, y en la duodécima semana de gestación la conexión vascular entre el hipotálamo y la hipófisis es funcional. Se ha documentado producción de gonadotropinas durante la vida fetal, la infancia y la vida adulta. Se pueden cuantificar concentraciones considerables de FSH y LH, similares a las posmenopáusicas, en el feto. La GnRH es detectable en el hipotálamo a las 10 semanas de gestación y a las 10-13 semanas, cuando la conexión vascular es completa, se producen la FSH y LH en la hipófisis. Las concentraciones hipofisiarias máximas de FSH y LH se observan a las 20-23 semanas de vida intrauterina, y las máximas concentraciones circulantes, a las 28 semanas.
La tasa de producción creciente de gonadotropinas hasta la mitad de la gestación refleja la capacidad cada vez mayor del eje hipotalámico-hipofisario de funcionar con toda su capacidad. Comenzando a mitad del embarazo, existe una sensibilidad creciente a la inhibición por los esteroides y una reducción resultante de la secreción de gonadotropina. La sensibilidad completa a los esteroides no se alcanza hasta el final de la lactancia. El incremento de las gonadotropinas después del nacimiento refleja la perdida de las grandes concentraciones de esteroides placentarios. Así pues, en el primer año de vida, hay una considerable actividad folicular en los ovarios en comparación con el final de la infancia, cuando se suprime la secreción de gonadotropinas. Además, el aumento posnatal de las gonadotropinas es incluso mayor en los lactantes prematuros.
Tras el incremento posnatal, las concentraciones de gonadotropinas alcanzan un nadir durante el principio de la infancia (aproximadamente a los 6 meses de vida en los varones y al cabo de 1-2 años en las mujeres) y luego aumentan ligeramente entre los 4 y los 10 años. Este periodo infantil se caracteriza por bajas concentraciones de gonadotropinas en la hipófisis y la sangre, escasa respuesta de la hipófisis a la GnRH y supresión hipotalámica máxima. Este bajo grado de actividad no es mantenido por los ovarios ni los testículos porque la extirpación de las gónadas provoca pocos cambios. Los niños sin gónadas muestran este mismo bajo grado de actividad. Debe funcionar una fuerza inhibidora central en el encéfalo que aguarda una señal para iniciar la pubertad.
Se desconoce la señal exacta que inicia los fenómenos de la pubertad. En las niñas, los primeros esteroides que aumentan en la sangre son la deshidroepiandrosterona (DHA) y su sulfato (DHAS) a partir de los 6-8 años de edad, poco después de que la FSH empiece a aumentar. Las concentraciones de estrógenos y de LH no empiezan a aumentar hasta los 9-12 años de edad. Si el inicio de la pubertad está desencadenado por la primera hormona que aumenta en la circulación, entonces se debe considerar una función de los esteroides suprarrenales. Sin embargo, no hay datos que indiquen que tales esteroides son necesarios para la cronología adecuada de la pubertad, y la adrenarquia es independiente; no está controlada por el mismo mecanismo que activa las gónadas. El estado de nutrición influye en la función reproductora, y es probable que el sistema de comunicación de la leptina contribuya al comienzo de la pubertad, pero es improbable que sea la señal principal. La pubertad es como la reunión de múltiples sistemas e influencias, tales como factores genéticos, metabólicos y hormonales.
La edad de comienzo de la pubertad es variable y está influida por factores genéticos, las condiciones socioeconómicas y el estado general de salud. Es indudable que el adelanto actual de la menarquia (inicio de la menstruación) en comparación con el pasado se debe a la mejor nutrición y salud.
En la mujer, la secuencia típica de acontecimientos es inicio del crecimiento, telarquia (desarrollo de mamas), pubarquía (crecimiento de vello pubiano) y finalmente menarquia. Por lo general, esto comienza en algún momento entre los 8 y los 14 años de edad. Esta evolución suele durar 2-4 años. Durante este periodo, se dice que se produce la pubertad. La variación individual en el orden de aparición de esta secuencia es considerable. Por ejemplo, no siempre están correlacionados el crecimiento del vello púbico y el desarrollo de las mamas.